La maladie d’Alzheimer
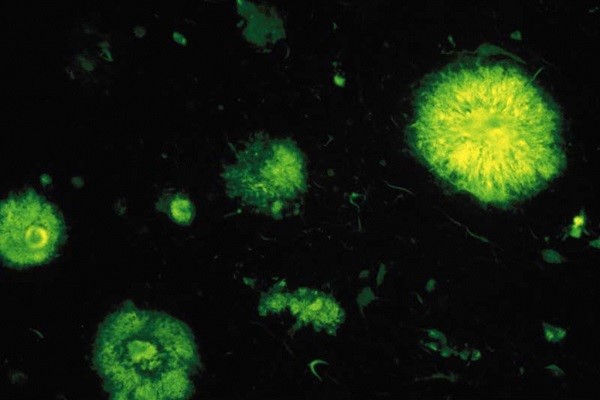
Plaques séniles, ou plaques amyloïdes, observées en fluorescence dans un cas de maladie d’Alzheimer © Inserm/U837
Description de la maladie
La maladie d’Alzheimer affecte aujourd’hui entre 855 000 et 1 000 000 de personnes en France et on estime à plus de 225 000 le nombre de nouveaux cas chaque année. Près d’un million et demi de personnes pourraient être affectés dès 2020. L’activité intellectuelle et physique est un facteur préventif . Plusieurs dizaines de médicaments sont en cours de développement pour soigner cette grave maladie neurodégénérative. Malgré ces efforts, à ce jour aucun traitement efficace n’a pu être découvert. Les thérapies les plus innovantes et les plus prometteuses n’ont pu prouver aucun impact significatif sur le cours de la maladie. De l’avis même des experts internationaux, le traitement de référence (par inhibiteur d’acétylcholinestérase) n’a qu’un bénéfice limité pour les patients. Ce constat est dû à trois raisons : Tout d’abord l’absence de compréhension fine des mécanismes de la maladie, c’est à dire des premières altérations du fonctionnement des neurones dans le cerveau. Ensuite, le fait qu’au moment du diagnostic de la maladie, celle-ci a déjà trop gravement affecté le cerveau. Enfin, la maladie d’Alzheimer regroupe plusieurs sous-groupes de la maladie. Un médicament donné peut ainsi être efficace sur un de ces sous-groupes, mais inutile pour les autres.
La situation serait probablement différente si on pouvait :
– intervenir plus tôt, à un moment où le cerveau peut encore compenser les effets de la maladie et dispose d’une « réserve fonctionnelle » suffisante
– distinguer les différentes formes de la maladie.
La réponse de l’Institut du Cerveau – ICM
L’équipe du Professeur Charles Duyckaerts cherche à comprendre les mécanismes physiologiques qui conduisent à la maladie d’Alzheimer : Ces chercheurs s’intéressent à la production et à la sécrétion de peptides amyloïdes qui formeront les plaques séniles retrouvées dans le cerveau des patients atteints de maladie d’Alzheimer, et à leur toxicité. La microdissection de plaques séniles couplée à des techniques d’analyse de pointe a permis de trouver de nouveaux composants de nature lipidique qui s’y accumulent dont le cholestérol. En augmentant spécifiquement le cholestérol de la membrane de cellules en culture, l’équipe a montré que la protéine précurseur des peptides amyloïdes est relocalisée dans des zones spécifiques riches en cholestérol, accélérant ainsi son internalisation dans un compartiment cellulaire propice au clivage de ce précurseur. Parallèlement, cette équipe étudie une forme de la maladie d’Alzheimer qui survient vers 40 ans chez des patients porteurs d’une trisomie 21. Il s’agit d’une forme précoce pour laquelle l’équipe a découvert un biomarqueur : l’augmentation de taille des endosomes, structures subcellulaires dans lesquels sont produits les peptides amyloïdes.
Grâce à l’interaction entre l’observation clinique de patients cérébro-lésés et un plateau technique exceptionnel qu’offre l’Institut du Cerveau – ICM, l’équipe du Pr Bruno Dubois a pu progresser dans la connaissance des grandes fonctions du cerveau et de leur dysfonctionnement au cours de la maladie d’Alzheimer. L’étude de patients amnésiques par IRM et magnéto-encéphalographie leur a permis de préciser le rôle de l’hippocampe dans la mémoire épisodique et dans des phénomènes complexes d’hallucinations et de confabulations. Après l’étude d’importantes cohortes de patients, le professeur Bruno Dubois avec son équipe a montré qu’il sera possible de prédire l’arrivée des signes cliniques de la maladie d’Alzheimer 3 ans avant que ceux-ci ne surviennent grâce à la détection de troubles de mémoire très spécifique (du type « hippocampique ») et à la modification de la concentration de certaines protéines dans le liquide céphalo-rachidien.
_____________________________________
La maladie de Parkinson
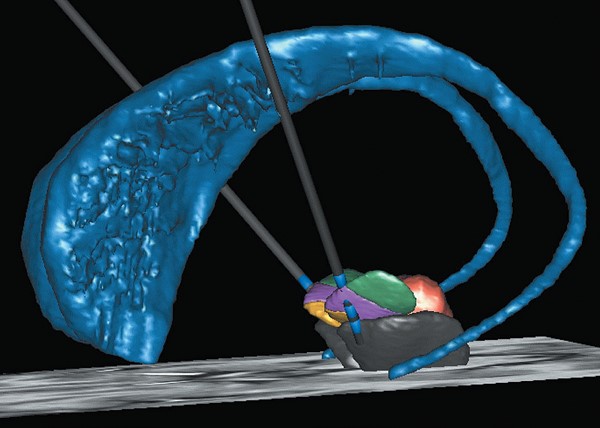
La stimulation cérébrale profonde dans la maladie de Parkinson
Description de la maladie
La maladie de Parkinson connaît une croissance forte. Elle touche aujourd’hui 140 000 personnes dans notre pays, entraînant invalidité et perte d’autonomie. Plusieurs traitements sont actuellement disponibles et permettent une amélioration de la qualité de vie et une diminution des symptômes chez les malades. Cependant, ces médicaments ne sont efficaces que sur une partie des patients et, fondamentalement, ne permettent pas la guérison de cette maladie. Cette situation est due en partie au diagnostic trop tardif des lésions cérébrales occasionnées, à un moment où elles sont devenues difficilement réparables. En effet, au moment des premiers symptômes de la maladie, près de 80 % des neurones de la substantia nigra (substance noire), la petite région du cerveau détruite par la maladie, sont déjà perdus. La maladie se caractérise par la mort d’une population de neurones, présents dans la substance noire, qui produisent de la dopamine (neurotransmetteur). La diminution de la concentration de dopamine est à l’origine de la maladie. Cette dernière évolue dans le temps et aussi dans l’espace : d’autres neurones vont mourir en plus des neurones dopaminergiques et les stigmates histo-pathologiques se situent d’abord dans les parties basses du cerveau puis diffusent pour atteindre le cortex cérébral à un stade avancé de la maladie. Outre la stimulation cérébrale profonde, Le traitement actuel consiste à restaurer les concentrations normales de dopamine ou à utiliser des mimétiques de la dopamine appelés des agonistes. Comme pour la maladie d’Alzheimer et la plupart des grandes maladies du système nerveux, des difficultés majeures subsistent pour arriver à de nouvelles thérapies. Il faut tout d’abord comprendre au niveau cellulaire les mécanismes de la maladie pour pouvoir les bloquer. Ensuite, il faut pouvoir diagnostiquer la maladie suffisamment tôt pour que les traitements puissent être efficaces ; il faut enfin identifier les différentes formes de la maladie, chacune pouvant nécessiter un traitement particulier.
La réponse de l’Institut du Cerveau – ICM
L’équipe du Pr Alexis Brice aborde la problématique de la compréhension des mécanismes avec des familles atteintes de formes familiales de la maladie de Parkinson. L’étude du patrimoine génétique de ces familles lui a déjà permis d’identifier des gènes majeurs dans le développement de la maladie, dont celui de la parkine. En identifiant le fonctionnement des protéines codées par ces gènes et leurs rôles dans les cellules nerveuses, son équipe a pu montrer des anomalies de forme et de fonction des mitochondries.
Pour ralentir l’évolution de la maladie, l’équipe du Dr Étienne Hirsch s’est intéressée aux mécanismes moléculaires et cellulaires de la mort des neurones dopaminergiques. Si on sait qu’une concentration trop forte de calcium est impliquée dans la mort neuronale, une trop faible concentration de calcium l’est également d’où la possibilité d’utiliser des molécules qui agissent sur l’homéostasie du calcium. Ces chercheurs ont montré le rôle crucial de la neuro-inflammation dans la maladie : l’équipe a progressé dans l’étude des interactions entre les neurones dopaminergiques et les cellules du système immunitaire. En effet, les phénomènes neuroinflammatoires contribuent à perpétuer les processus de mort neuronale. Etienne Hirsch et Stéphane Hunot ont pu montrer le rôle des lymphocytes et identifier les signaux de souffrance des neurones dopaminergiques. Ces découvertes ouvrent des voies thérapeutiques prometteuses car elles permettent, sur la base d’une compréhension fine de la maladie, d’identifier les molécules efficaces pour la soigner.
Pour affiner le diagnostic de la maladie et en séparer les différentes formes, l’équipe du Professeur Marie Vidailhet constitue des cohortes c’est à dire des groupes de patients, sains ou malades, suivies pendant plusieurs années pour identifier les marqueurs prédisant l’arrivée de la maladie, qu’il s’agisse de marqueurs sanguins, de neuroimagerie ou d’autres facteurs. Le Professeur Vidailhet est par ailleurs une experte de toutes les formes de dystonies, pour lesquelles elle a obtenu des améliorations spectaculaires en utilisant la stimulation cérébrale profonde (un dispositif miniaturisé permettant de stimuler l’action des neurones dans les régions d’intérêt du cerveau). Grâce au dialogue constant entre médecins et chercheurs, des observations cliniques ont déjà permis d’identifier des candidats médicaments prometteurs, évalués dans le Centre d’Investigation Clinique (CIC) de l’Institut du Cerveau – ICM.
________________________________________
L’épilepsie
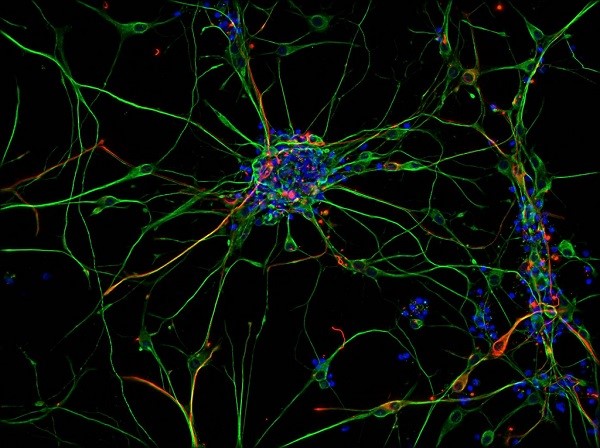
Culture dissociée de neurone adulte humain issue d’une résection hippocampique à visée thérapeutique. Auteur : Eugène, Emmanuel. Copyright : Inserm
Description de la maladie
L’épilepsie, souvent considérée au début du siècle dernier comme une maladie psychiatrique, est une des maladies neurologiques chroniques les plus fréquentes ; 400 000 malades sont recensés en France. Cette maladie touche tous les âges de la vie avec un plus grand nombre chez l’enfant et chez les personnes âgées. Par an, 30 000 nouveaux patients sont diagnostiqués. L’épilepsie peut se manifester par une seule crise ou par des crises tout au long de la vie. Les conséquences de cette maladie dans la vie sociale sont importantes : les patients n’ont pas l’autorisation de conduire, certaines professions leur sont interdites. Ils peuvent parfois se heurter à des problèmes relationnels au cours de leur vie sociale.
L’épilepsie est due à une décharge électrique anormale et paroxystique (très brève) de neurones du cortex cérébral. La maladie peut être causée par une lésion, qu’il s’agisse d’une tumeur cérébrale, de séquelles d’un AVC ou d’un traumatisme crânien grave. Ce type d’épilepsie symptomatique peut répondre favorablement à un traitement médicamenteux ou chirurgical. La maladie peut correspondre à un dysfonctionnement du cerveau sans lésion structurelle, on parle d’épilepsie idiopathique. L’épilepsie idiopathique est souvent liée à des facteurs génétiques et est donc due à un dysfonctionnement de certains gènes dont quelques-uns sont déjà identifiés. Le plus souvent, l’anomalie se corrige avec le temps grâce au phénomène de maturation. L’épilepsie peut naitre de n’importe quelle région du cortex cérébral, on parle alors d’épilepsie partielle ou focale. Les épilepsies focales représentent 70% de toutes les épilepsies. En conséquence, il existe une grande variabilité des symptômes épileptiques car ils sont étroitement liés à la localisation des neurones qui s’activent de façon anormale. La crise a ensuite tendance à se propager et « enflamme » une plus grande surface corticale. Le patient, qui était conscient jusqu’alors, est absent, et peut avoir un comportement dangereux pour lui-même puis convulser. Là encore les symptômes sont variables en fonction du type d’épilepsie idiopathique : le patient peut perdre conscience et être pris de convulsions très impressionnantes. Les cliniciens disposent de nombreux médicaments mais aucun n’est curatif. Les médicaments anti-épileptiques visent à empêcher les crises en diminuant l’excitabilité neuronale et certains sont adaptés à tel ou tel type d’épilepsie. Dans le cas où il s’agit d’une tumeur cérébrale qui provoque les crises, le patient est opéré et la guérison peut être complète. Dans une situation plus complexe, le traitement médicamenteux devra être maintenu pendant de très nombreuses années. Lorsque la région corticale d’où partent les crises est définie et si sur l’IRM on constate qu’il existe une lésion dans cette région, on peut donc envisager une chirurgie limitée à cette lésion. Cette chirurgie permet souvent une guérison complète du patient.
La réponse de l’Institut du Cerveau – ICM
L’Institut du Cerveau – ICM se caractérise par l’existence d’un lien très étroit entre l’activité clinique et la recherche : Le fait que l’Institut du Cerveau – ICM soit implanté au sein de l’hôpital facilite l’accès aux patients épileptiques grâce à la collaboration des services hospitaliers, avec Vincent Navarro, Michel Baulac, les équipes d’Eric Leguern et Stéphanie Baulac, de Stéphane Charpier et de Richard Miles. Les axes de recherche sont multiples et complémentaires dans le domaine de la génétique et de l’électro-physiologie. Les services cliniques recrutent les patients dont les prélèvements sanguins sont analysés au sein de l’Institut du Cerveau – ICM pour identifier des gènes impliqués dans la maladie. Les enregistrements de l’activité cérébrale des patients sont réalisés par le clinicien puis l’ensemble des données sont transférées par fibre optique vers les laboratoires de l’Institut du Cerveau – ICM, stockées sur de puissants serveurs et analysées par les chercheurs. Ces derniers se consacrent à la recherche sur l’épilepsie en utilisant des approches différentes mais le fait que ces équipes travaillent dans un même lieu, au sein de l’Institut du Cerveau – ICM, permet une étroite collaboration avec la possibilité de réaliser des expériences in Vitro et in Vivo.
L’équipe d’Eric Le Guern et de Stéphanie Baulac s’intéresse aux aspects génétiques et physiopathologiques des formes familiales d’épilepsies et à l’élucidation de leurs bases moléculaires. L’identification des gènes impliqués dans la maladie va pouvoir permettre de trouver les défauts responsables des crises et d’en comprendre les différents mécanismes. Récemment, cette équipe a étudié des formes familiales comportant plusieurs membres atteints.
L’équipe de Stéphane Charpier travaille sur des formes d’épilepsie du néocortex, le cortex le plus en surface, en réalisant des études électrophysiologiques à différents niveaux d’intégration : de la membrane neuronale aux réseaux synaptiques à grande échelle. Sa recherche s’est notamment concentrée sur l’épilepsie « absence » de l’enfant, qui ne dure que quelques secondes durant lesquelles le jeune patient s’immobilise. Stéphane Charpier et ses collaborateurs ont découvert que les crises « d’absence » sont initiées dans une sous-population de neurones corticaux dits « pyramidaux », plus excitables que les autres neurones du cortex. Néanmoins, ceux-ci sont inhibées par le GABA (acide gamma-amino butyrique), neurotransmetteur habituellement facilitateur . Les résultats obtenus par cette équipe conduisent à revisiter les mécanismes de généralisation des crises d’absence et le rôle du GABA dans les mécanismes de déclenchement des crises. Dans le cadre d’un projet européen appelé « EPILEPSIAE », Michel le van Quyen au sein de l’équipe de Stéphane Charpier a mis au point des méthodes d’anticipation des crises basées sur l’analyse mathématique des électroencéphalogrammes et grâce à des enregistrements réalisés à partir de microélectrodes intracérébrales permettant d’enregistrer l’activité des neurones individuels. Ces travaux permettront de prévoir la survenue de certaines crises, de mieux comprendre les mécanismes de « préparation » cérébrale des crises et d’envisager la mise au point d’un « système d’alerte » en temps réel.
Richard Miles et ses collaborateurs concentrent leur recherche sur l’épilepsie partielle dont le foyer est situé dans le lobe temporal au niveau de l’hippocampe. L’épilepsie du lobe temporal suit un processus très stéréotypé : les crises focales se déclarent 5 ans ou 10 ans après une convulsion fébrile ou une infection qui provoquent la mort de neurones de l’hippocampe. Ces chercheurs s’intéressent aux causes moléculaires de la mort neuronale et au mécanisme de l’épileptogénèse qui en découle. Ces travaux sont menés sur des coupes de tissus épileptiques (prélevés lors d’opérations chirurgicales) maintenus en activité pendant plusieurs heures.






