Une tumeur est formée par des cellules qui se multiplient de façon incontrôlée, détournent à leur profit les cellules environnantes et peuvent, à des degrés divers perturber le fonctionnement du cerveau.
Une tumeur cérébrale peut se développer dans n’importe quelle zone du cerveau.
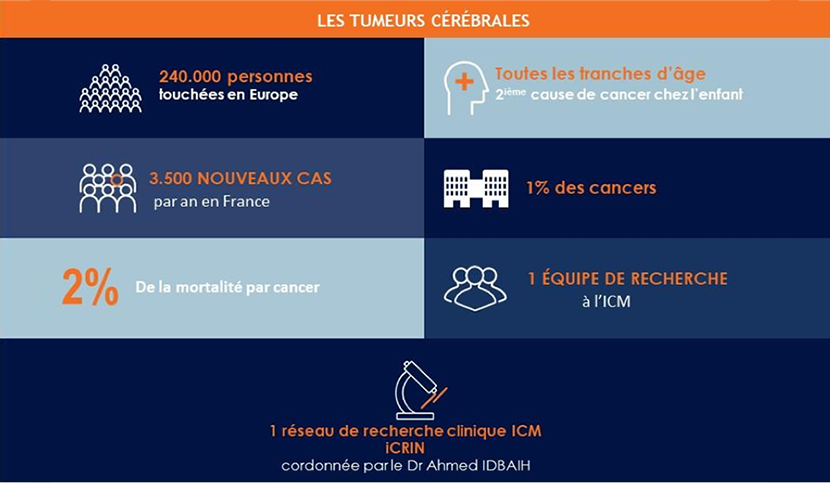
On distingue les tumeurs primitives du cerveau issues de cellules résidentes du cerveau, et qui représentent 1% des cancers, et les tumeurs cérébrales secondaires beaucoup plus fréquentes formées par des cellules cancéreuses provenant d’un autre organe : poumon, sein, colon, rein, peau (mélanome) notamment, et constituant des métastases ( processus par lequel les cellules cancéreuses se propagent dans l’organisme pour atteindre et se multiplier dans d’autres organes que celui initialement touché).
On distingue plus de cent types différents de Tumeurs cérébrales primitives. Les plus fréquentes sont développées à partir des cellules gliales, ou de leurs précurseurs, on parle alors de gliomes qui comprennent les astrocytomes, les oligodendrogliomes et les glioblastomes. Les gliomes entraînent rarement des métastases dans d’autres organes.
Les méningiomes, développés au dépend des méninges entre le crâne et le cerveau, sont des tumeurs fréquentes mais le plus souvent sans caractère cancéreux.
LES CAUSES DES TUMEURS CÉRÉBRALES
Les tumeurs cérébrales ne sont généralement pas héréditaires, en dehors de contextes, cependant on a identifié des marqueurs génétiques qui augmentent très légèrement le risque de développer ce type de cancer pour un individu donné.
Généralement le cancer est lié à la survenue de mutations successives survenant dans une cellule donnée et sur des gènes spécifiques à l’origine de la prolifération des cellules qui forment la tumeur. Ces mutations ne sont présentes que dans les cellules du cancer et non dans l’organisme entier. Elles ne sont donc pas héréditaires.
LES SYMPTÔMES ET LE DIAGNOSTIC DES TUMEURS CÉRÉBRALES EST-IL ÉTABLIT ?
Les symptômes de la tumeur du cerveau dépendent de la nature de la tumeur, de sa localisation dans le cerveau, de sa taille et de sa vitesse d’évolution.
Les symptômes pouvant révéler une tumeur cérébrale sont variés et dépendent de la localisation de la tumeur à l’intérieur du cerveau, et de sa vitesse de croissance.
Une tumeur cérébrale peut aussi être révélée par une crise d’épilepsie. C’est le mode de révélation le plus fréquent des tumeurs d‘évolution lente.
LES TRAITEMENTS DES TUMEURS CÉRÉBRALES
Comme pour les autres cancers, le traitement des tumeurs cérébrales repose essentiellement sur la chirurgie, la radiothérapie et la chimiothérapie, suivant les cas.
Le traitement des tumeurs cérébrales primitive, et notamment des gliomes est difficile pour différentes raisons : i) leur localisation qui rend la chirurgie limitée, voire impossible, ii) la barrière hémato-encéphalique qui isole et protège le cerveau de substances pathogènes mais limite la pénétration des médicaments anti-cancéreux, iii) la résistance intrinsèque à la radio- et à la chimiothérapie de bon nombre de tumeurs, iiii) la fragilité du tissu cérébral aux fortes doses de radiothérapie.
Néanmoins, les recherches actuelles, tant au niveau recherche fondamentale pour comprendre les mécanismes biologiques des tumeurs que les recherches cliniques devraient aboutir à de nouvelles pistes thérapeutiques ciblées et personnalisées. Déjà, des thérapies innovantes, ciblées ont prouvé leur efficacité sur des sous-groupes très particuliers
Dernière mise à jour août 2023.